
Ученые обнаружили изменения в неврологической структуре, которые могут лежать в основе расстройства аутистического спектра, известного как синдром Питта-Хопкинса, благодаря лабораторно выращенному мозгу, созданному из человеческих клеток.
Кроме того, исследователи смогли восстановить утраченные генетические функции с помощью двух различных стратегий генной терапии, что намекает на возможность создания методов лечения, которые в один прекрасный день дадут людям с этим заболеванием новые возможности для улучшения качества жизни.
Синдром Питта-Хопкинса — это заболевание нейроразвития, вызванное мутацией в гене управления ДНК под названием транскрипционный фактор 4 (TCF4). Отнесенное к спектру аутизма из-за серьезного влияния на моторные навыки и сенсорную интеграцию, это сложное состояние, которое проявляется с разной степенью тяжести.
Более того, изменения в гене TCF4 связаны с другими формами аутизма и различными нейроразвивающими заболеваниями, включая шизофрению.
Несмотря на его очевидное значение в развитии нашего мозга, мы удивительно мало знаем о механизмах работы этого гена, как в его типичной, так и в мутировавшей форме.
Исследователи из Университета Кампинаса в Испании и Калифорнийского университета в Сан-Диего (UC San Diego) решили изменить эту ситуацию, изучив работу генов в среде, максимально приближенной к развивающемуся мозгу.
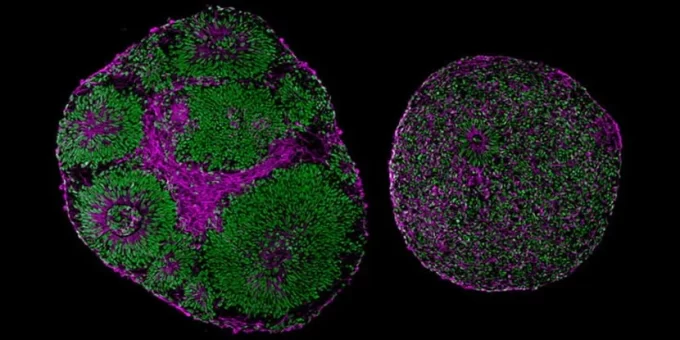
Клетки кожи, взятые у добровольцев с диагнозом «синдром Питта Хопкинса», были перепрограммированы в стволовые клетки, которые сформировали основу мозгоподобной массы, называемой органоидом коры головного мозга.
Органоиды — это упрощенные версии настоящего мозга, не способные выполнять все функции, ожидаемые от настоящего органа. Тем не менее, они помогают исследователям изучать некоторые аспекты мозга, демонстрируя такие особенности, как порядок развития тканей и каскад химических триггеров, которые мы можем наблюдать у растущего плода.
Изучая развитие тканей с мутировавшими версиями TCF4, взятых у людей с синдромом Питта Хопкинса, и сравнивая их с тканями с более типичными генами TCF4, исследователи смогли составить карту изменений в структуре и работе тканей.
«Даже без микроскопа можно было определить, в каком органоиде мозга произошла мутация», — говорит педиатр Алиссон Р. Муотри из Калифорнийского университета в Сан-Диего.
Органоиды, созданные с помощью атипичных генов TCF4, были заметно меньше, чем контрольные органоиды, например, некоторые из них демонстрировали поляризованное искажение общей структуры.
Исследователи также обнаружили, что версия гена, ответственная за синдром Питта-Хопкинса, замораживает клетки-предшественники, дающие начало различным типам нейронов, нарушая их способность к диверсификации.
Это приводит к уменьшению количества нейронов в коре головного мозга, а также к снижению их активности — два фактора, которые могут помочь объяснить более глубокие различия в мозге при аутизме или шизофрении.
Частично причиной такого снижения нейронной дифференциации, по-видимому, является снижение определенного типа сигналов, проходящих через клеточные мембраны.
Искусственно поддерживая этот сигнал с помощью целевых фармацевтических препаратов, исследователи обнаружили, что им удалось вернуть хотя бы часть нейронного разнообразия и электрической активности в корковые области органоидов.
Генетическая коррекция мутации TCF4 в тканях также обратила эффект мутации вспять, сделав органоиды, созданные из добровольцев с синдромом Питта-Хопкинса, более похожими на контрольные органоиды.
«Тот факт, что мы можем исправить один ген, и вся нейронная система восстановится, даже на функциональном уровне, просто поразителен, — говорит Муотри.
Это небольшой ключевой фрагмент информации, который однажды может привести к созданию революционных методов лечения, хотя до этого дня еще далеко».
Органоиды не являются полностью функциональными мозгами, оставляя много места для упущенных факторов, которые могут усложнить ситуацию.
Более того, такие заболевания, как аутизм и шизофрения, становятся очевидными только после рождения. Не зная, как изменения в дифференциации и активности нервов влияют на функции более полно сформированного мозга, невозможно определить ценность подобных методов лечения.
Но хотя это небольшой шаг к пониманию того, как развиваются некоторые нарушения нейроразвития, это также прорыв, который может дать тем, кто пострадал от мутировавшего гена, возможность выбора, как управлять своим здоровьем.
«Для этих детей и их близких любое улучшение моторно-когнитивных функций и качества жизни стоит того, чтобы попробовать», — говорит Муотри.
Это исследование было опубликовано в журнале Nature Communications.
Оригинал earth-chronicles.ru
